LES NOUVELLES PANDEMIES
Un certains nombre de nouvelles maladies transmissibles à l’homme ont fait leur apparition dans le monde qui nécessitent de par leur développement rapide et leur transmissibilité une réactivité importante et une accélération des recherches afin d’éviter leur généralisation à la population des pays où elles se déclarent mais aussi, via leur importation, à l’ apparition d’épidémies au niveau mondial .
Nous reprenons quelques une d’entre elles, plus ou moins bien connues, et qui ont déjà fait des ravages dans toutes sortes de population .
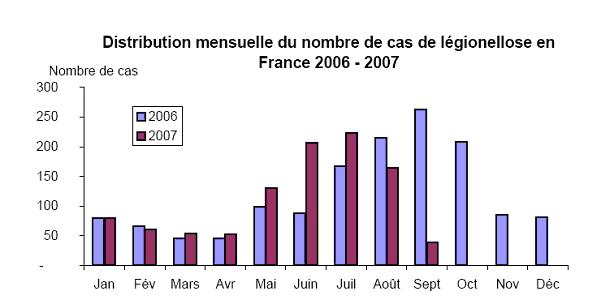
La légionellose
La légionellose est une maladie connue depuis 1976 (épidémie de légionellose survenue chez des anciens combattants de l’American Legion )
Epidémiologie
La fréquence de la maladie des légionnaires est vraisemblablement sous-estimée, particulièrement en ville (estimation de 145O cas de légionellose avec une exhaustivité de la déclaration de 30% en France).
Modalités de transmission et cibles
Réservoir
Legionella pneumophila est présente dans le milieu naturel (eaux, terre).
Prolifération
Legionella pneumophila peut proliférer dans les sites hydriques artificiels lorsque les conditions de son développement sont réunies, particulièrement entre 25 et 45°C, conditions présentes dans les installations à« risque » :
- réseaux d’eau chaude collectifs complexes (hôpitaux, hôtels),
- tours aéro – réfrigérantes (circuits chauds industriels ou groupes frigorifiques utilisés en climatisation,
– systèmes de traitement d’air (batteries froides, techniques d’humidification de l’air),
-autres installations (bains à remous ou à jets, balnéothérapie ou thermalisme, etc…)
Contamination
Elle se fait par voie respiratoire, par inhalation d’eau en aérosol ; une instillation directe au niveau des bronches est possible.
Facteurs favorisants
Bien que la moitié des cas surviennent chez des adultes sains, des facteurs favorisants et des populations à risque ont été identifiés :
– sujet âgé,
– tabagisme, alcoolisme,
-diabète, maladie pulmonaire chronique, néoplasie, insuffisance rénale sévère, déficit immunitaire,
Diagnosticde la maladie des légionnaires
Eléments d’orientation
- Pneumonie communautaire ou nosocomiale.
- Présence de signes extra-pulmonaires (neurologiques, digestifs, cardiaques, … ).
- Recherche d’autres cas, appréciation du contexte épidémique, notion d’alerte locale ou régionale.
Eléments de confirmation biologique
- soit par la recherche de l’antigène de Legionella pneumophila de type 1( fréquent dans les urines),
- soit par le dosage d’anticorps
Intérêt d’un diagnostic de certitude
- à l’échelon individuel : chez les patients atteints de formes sévères, il est important de connaître le diagnostic en raison de la relation entre la gravité de la maladie et la rapidité du traitement par antibiotiques appropriés ;
- à l’échelon collectif : la légionellose étant une maladie à déclaration obligatoire, le diagnostic de certitude permet de suivre l’évolution, de détecter les cas groupés et de mettre en place des mesures de prévention.
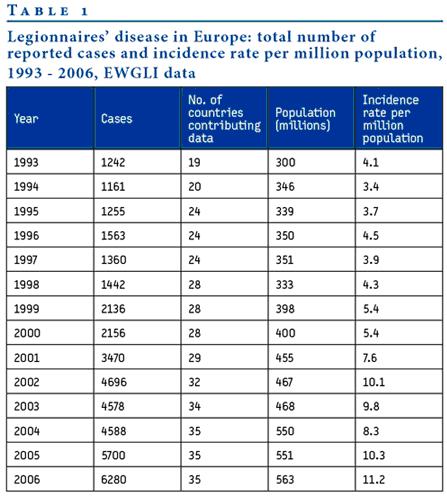
La Légionellose en Europe,
Une fois par an, les pays du Groupe de travail européen pour la surveillance de la légionellose associée aux voyages (EWGLINET) doivent fournir une série de données portant sur des informations épidémiologiques et micro biologiques des cas de légionellose détectés dans leur pays dans l’année en cours.
En 2003 et 2004., 9166 cas ont été déclarés dans 35 pays, dont 941 cas associés à des épidémies. Quatorze pays ont rapporté un total de 218 épidémies détectées.
Le taux d’infection variait d’un pays à l’autre, allant de 28,7% à moins de un cas par million d’habitants. Au cours des deux années, le décès a été rapporté pour 748 cas, soit un taux de mortalité de 8,2%.
Le manque d’informations épidémiologiques détaillées sur les décès dus à la légionellose est évident. La création du Centre européen pour le contrôle et la prévention des maladies est l’opportunité de développer des collaborations européennes plus fortes et d’améliorer la protection face aux épidémies de légionellose des Européens.
La grippe aviaire A (H5N1)
La grippe aviaire est une infection par un virus grippal qui comprend plusieurs genres (ou types) dont influenza virus A. Celui-ci est divisé en sous-types parmi lesquels H5 et H7. Cette infection peut toucher presque toutes les espèces d’oiseaux, sauvages ou domestiques. Elle peut être fortement contagieuse, surtout chez les poulets et les dindes, et peut entraîner une mortalité extrêmement élevée en particulier dans les élevages industriels. Le virus aviaire infecte parfois d’autres espèces animales, notamment le porc.
Modalités de transmission
Les virus de la grippe aviaire peuvent exceptionnellement être transmis à l’homme. Cette transmission s’effectue essentiellement lors de contacts fréquents et intensifs avec des secrétions respiratoires et des déjections d’animaux infectés.
Tableauclinique et diagnostique chez l’homme
Infection respiratoire aiguë sévère, d’évolution souvent fatale. L’infection peut également prendre d’autres formes cliniques (digestives, par exemple), Le diagnostic biologique est réservé à certains laboratoires spécialisés. Des traitements antiviraux peuvent, dans certaines situations, avoir une certaine efficacité en prévention ou dans la prise en charge thérapeutique.
Le risque majeur représenté par les virus aviaires A(H5N1) est qu’il s’adapte à l’homme et qu’une transmission inter-humaine s’installe. Ce virus peut s’adapter de deux façons : soit en mutant progressivement, soit en se recombinant avec une souche virale humaine. Cette recombinaison pourrait survenir chez un hôte intermédiaire (porc) ou chez l’homme à l’occasion d’une co-infection. Une souche re combinée ou qui aurait mutée pourrait acquérir une capacité de transmission inter -humaine. Le risque de dissémination deviendrait alors important, compte tenu de l’absence d’immunité de la population mondiale vis-à-vis de cette nouvelle souche.
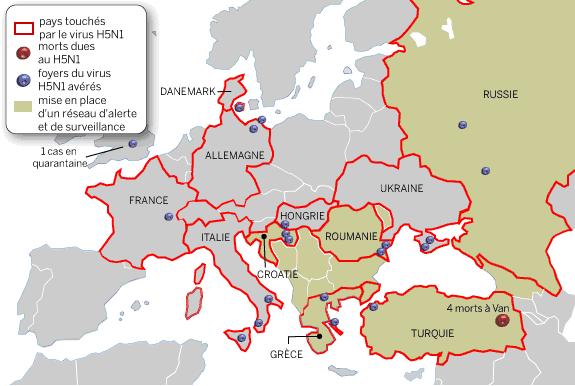
En décembre 2003, une souche virale de type A(H5N1), a été identifiée dans des foyers de grippe aviaire en République de Corée . De nombreux autres foyers aviaires causés par ce virus ont été depuis identifiés dans plusieurs pays d’Asie. La grippe aviaire a fait sa réapparition dans l’Union européenne après six mois d’absence. La Commission européenne a confirmé, ( janvier 2007) la présence du virus H5N1 dans un élevage hongrois et (février 2007) dans un élevage britannique.
février 2006
Epidémiologie
Depuis le début de l’épizootie (décembre 2003), 13 pays ont été touchés : Cambodge, Chine, Corée du Sud, Indonésie, Japon, Kazakhstan, Laos, Malaisie, Mongolie, Russie (Sibérie), Thaïlande, Turquie et Vietnam.
Situation des cas humains en Asie du sud est
Pour la plupart des cas humains décrits en Asie, la contamination a pour origine des contacts avec des animaux malades ou morts, ou avec leurs déjections. Cependant, la possibilité d’une contamination inter-humaine consécutive à des contacts étroits et répétés au sein de groupes familiaux a été évoquée en Thaïlande, au Vietnam au Cambodge et en Indonésie. Toutefois, cette possible transmission inter-humaine est restée limitée et n’a pas donné lieu à une transmission communautaire secondaire.
Les mesures de contrôle
Sur le plan animal, les mesures recommandées consistent en une mise en quarantaine des foyers animaux identifiés, puis leur abattage, ainsi que celui des animaux potentiellement exposés.
Afin d’éviter une contamination de ferme à ferme, il est nécessaire d’appliquer rigoureusement des procédures de décontamination du matériel utilisé dans ces fermes (vêtements, voitures…). Les principales recommandations insistent sur la nécessité d’élever les différentes espèces animales séparément, en évitant notamment tout contact entre les volailles et les porcs, de mener des campagnes de vaccination sur ces animaux dans les zones à haut risque de transmission, et d’encourager les éleveurs à signaler les cas suspects de grippe aux autorités en prévoyant un dédommagement adéquat pour le préjudice financier subi en cas d’abattage.
Sur le plan humain, des mesures de précautions individuelles sont recommandées pour les personnes exposées à des volailles infectées. De même, pour les voyageurs se rendant dans des zones où il existe des foyers animaux, il convient de respecter certaines précautions . A l’heure actuelle, il n’existe aucun vaccin humain contre la grippe aviaire A(H5N1).
Europe
Le risque de pandémie grippale est pris en compte par les pays de la Communauté Européenne, et notamment par la France qui dispose d’un plan gouvernemental de lutte élaboré dans la perspective d’un tel événement.
Il est impossible de prévoir si une pandémie de grippe peut se produire. Pourtant, la Commission, en coopération avec les Etats Membres et des organisations internationales telles que l’OMS cherche à promouvoir un niveau de protection maximum pour faire face à ce danger .
Depuis 1998, l’UE s’est doté d’un système de réponse rapide nommé EWRS (Early Warning and Response System), qui permet une réaction rapide et coordonnée en cas de crise.
L’UE finance 20 millions d’euros de recherches pour développer un éventuel vaccin contre une pandémie de grippe
Qu’est-ce que le syndrome respiratoire aigu sévère (SRAS)?
Le SRAS est une forme grave de pneumonie, accompagnée d’une forte fièvre. On pense qu’il est causé par une nouvelle forme de corona -virus. Bien que le SRAS soit une maladie grave, il a un taux de guérison de 95 %.
Quels sont les signes et les symptômes de la maladie?
Les personnes qui ont eu des contacts étroits avec une personne souffrant du SRAS, ou qui ont voyagé dans les régions touchées par le SRAS, doivent surveiller les symptômes suivants pendant 10 jours à la suite du dernier contact :
• douleurs musculaires
• fatigue intense
• violents maux de tête
• ET montée soudaine de fièvre (plus de 38 ºC)
• ET symptômes respiratoires, y compris toux, essoufflement et difficulté à respirer.
3- Comment le SRAS se propage-t-il?
4- Que puis-je faire pour éviter de contracter le SRAS?
6- Qui devrait être mis en quarantaine (ou en isolement à la maison)?
7- Que dois-je faire si la Santé publique me met en quarantaine (isolement à la maison? )
8- Comment le SRAS est-il soigné?
9- Que dois-je faire si je présente des symptômes?
10-Les voyageurs qui arrivent de ces régions doivent-ils de retourner au travail ou à l’école ?
Le Chikungunya
Identification
Origine
Isolé en(Ouganda), à partir d’un prélèvement sanguin effectué en Tanzanie le 22 février 1953 sur un homme présentant fièvre et arthralgie.
Virus
Virion sphérique, enveloppé, de 60-70 nm de diamètre, . Très proche des virus de Mayaro, O’Nyong Nyong et Semliki, il est classé sous le type Chikungunya qui signifie en swahili « marché courbé ».
Viabilité
- Sensibilité aux médicaments : aucun agent antiviral disponible à ce jour.
- Sensibilité aux désinfectants : sensible à l’éthanol à 70%, à l’hypochlorite de sodium à 1% au glutaraldéhyde à 2%, aux solvants des lipides.
- Inactivation par des moyens physiques : inactivé par la chaleur sèche ou humide > 58°C ; sensible à la dessiccation (déshumidification).
Epidémiologie
Répartition géographique.
L’Afrique sub-saharienne, l’Asie du Sud-Est, et depuis 2005, l’océan indien.
Espèces infectées
- L’homme.
- Les mammifères (chimpanzé, certains animaux domestiques), les reptiles, les oiseaux.
- Les moustiques (Anopheles, Aedes, Culex, Mansonia, Eretmapodites, Coquillettidia).
Transmissibilité
- Homme : aucun cas confirmé de transmission de personne à personne, mais des cas de transmission materno – fœtale (de la mère à l’enfant) ont été constatés à l’Ile de La Réunion.
- Animal : essentiellement le moustique, famille des AEDES.
Maladie
Description
Incubation 4 à 7 jours. Apparition brutale d’un épisode fébrile durant 2 à 5 jours avec de forte fièvre (> 39°) et des céphalées frontales intenses.
Symptômes caractéristiques
- Arthralgie (douleur articulaire) localisée aux épaules, genoux, chevilles, poignées, et petites articulations.
- Myalgie (douleur musculaire).
- Autres symptômes possibles : petites hémorragies, nausées, vomissement, diarrhée, encombrement respiratoire.
Virémie
C’est la période pendant laquelle la personne infestée est porteuse du virus, soit de 5 à 14 jours après la première piqûre. Pendant cette période, le malade doit se protéger voire être isolée d’éventuelles nouvelles piqûres de moustiques qu’elle pourrait contaminer entraînant ainsi la réaction en chaîne de l’épidémie.
Traitement
Aucun. On préconise le repos et l’administration de salicylées (anti-inflammatoire). L’aspirine est toutefois déconseillée en cas d’hémorragies.
Convalescence
La période de convalescence dépend des individus. Elle peut varier de quelques jours à plusieurs semaines, avec une fatigue intense et une impossibilité de concentration intellectuelle. Les arthralgies (douleurs musculaires) peuvent persister durant trois mois, voire plusieurs années.
Immunisation
Aucun vaccin n’est disponible à ce jour. Le séquençage complet du génome viral chik a commencé au Centre National de référence des arboviroses de Lyon. Cette démarche devra entre autre déceler une éventuelle mutation du virus. Des possibles Vaccins anti – arboviroses pourraient être alors ultérieurement envisagés : pour celui du chik, l’étude de la faisabilité est en cours mais les délais d’obtention ne sont pas connus, cela sera probablement long.
Létalité
Plusieurs certificats de décès survenus en janvier 2006 mentionnent le chikungunya comme ayant pu contribuer au décès. Ces certificats concernent, pour la plus grande majorité d’entre eux, des personnes âgées présentant des pathologies chroniques sous jacentes mais également celui d’un enfant de 10 ans auparavant en bonne santé et d’un nouveau-né directement contaminé par sa mère.
Prévention
En zone infectée
- Réduction du nombre de gîtes larvaires par application de traitement larvicides
- Elimination des déchets urbains retenant l’eau (récipients, pneus, vases, …)
- Epandage aérien d’insecticides à très bas volume
En zone indemne
Interdire l’introduction d’animaux en provenance des zones infectées
Chez l’homme
- Utilisation de répulsif contre les vecteurs (spray, crème, gel, insecticides …)
- Aménagement des maisons (moustiquaires)
Les informations ci-dessus ont été synthétisées à partir des observations effectuées à l’île de La Réunion et des données recueillies auprès du :
CNRS
INSTITUT PASTEUR
AGENCE DE SANTE PUBLIQUE DU CANADA
Elles sont susceptibles de modifications en fonction des observations et recherches en cours.
L’apparition de foyers autochtones en Italie en juillet 2007.
Le 30 août 2007, les autorités sanitaires italiennes ont rapporté qu’une épidémie de chikungunya sévissait depuis début juillet dans la province de Ravenne, Région Emilie Romagne.
Plus d’une centaine de cas sont survenus, pour leur grande majorité dans 2 communes voisines. Le cas suspecté serait une personne revenant d’Inde (Kerala). La date de début des signes des cas autochtones se situe entre le 4 juillet et le 28 août. Un certain nombre de cas ont été biologiquement confirmés.
La transmission par Aedes albopictus, si elle n’est pas encore démontrée, est probable, d’autant que ce moustique a fortement proliféré cet été. Compte tenu de la densité toujours élevée et du signalement de cas récents, il n’est pas exclu que la transmission se poursuive plus ou moins activement. La réduction de cette transmission dépendra de l’efficacité des mesures de contrôle mises en place par les autorités italiennes.
Cet épisode en Italie atteste de la réalité du risque de transmission du virus chikungunya dans certaines zones d’Europe du sud. La région où sévit l’épidémie possède des caractéristiques climatiques assez proches de celles des départements français où Aedes albopictus est implanté ou suspecté de l’être (Alpes Maritimes, Haute Corse, Corse du Sud, Var).
Conclusion sur l’actualité épidémiologique du chikungunya au 3 septembre 2007.
L’apparition d’une probable circulation virale en Italie amène à renforcer la vigilance dans le sud de la France où les conditions climatiques sont similaires et où la présence du moustique vecteur est avérée.
Ce nouvel épisode rappelle l’importance d’informer les voyageurs se rendant dans les zones où circule le virus (pays du sous continent indien, de la zone Océan Indien, de l’Afrique de l’Est et maintenant de l’Italie, région d’Emilie Romagne)) de prendre des mesures de protection vis-à-vis des piqûres de moustiques durant leur séjour et de les inviter à consulter en cas d’apparition de signes fébriles dans les 12 jours suivant leur retour.
La Leishmaniose
Transmise par de petits moustiques, cette maladie tropicale gagne la France et cantonnée jusqu’alors en Provence et dans les Cévennes ; elle assiège aujourd’hui la région parisienne.
Le responsable :
Le réchauffement climatique et la population canine qui lui sert de vivier.
Selon l’OMS « c’est l’une des maladies parasitaires les plus complexes du monde. »
Le coupable :
La leishmanie, un parasite microscopique (une vingtaines d’espèces) Transmise par de petits moustiques, les phlébotomes, elle affecte d’abord le chien.
Affectant d’abord les personnes au système immunitaire fragilisé (sida) elle infecte, depuis 2004, outre les 6000 chiens recensés, une trentaine de personnes chaque année.
La maladie progresse très rapidement, un nombre indéterminé de chevaux, renards et rongeurs contribuant à le multiplier via les piqûres de moustIques.
Les voyages nord sud favorisent également le transport des moustiques.
La période d’incubation est très lente (jusqu’à 6 ans avant l’apparition des premiers symptômes : (amaigrissement, fièvre, perte de poils, griffes longues et cassantes, lésions cutanées)..
Le chien infecté transmettra à son tour le parasite aux phlébotomes qui le piquent qui le réinjecteront
à leur tour chez leur prochaine victime qui pourra être l’homme..
L’Afssa sonne l’alerte à coup de communiqués.
L’OMS met en garde contre l’utilisation de produits trop puissants qui conduiraient à l’apparition de variété résistantes définitivement invincibles.
Sous sa forme la plus grave, la leishmaniose viscérale ,
Presque toujours mortelle en l’absence d’un traitement long et coûteux atteint chaque année 500 000 personnes.
Elle n’a pas été détectée en Europe pour le moment mais plusieurs centaines de cas sont signalés chaque année sur la rive sud de la méditerranée.
Le Débat
Où en sommes nous en 2008 ?
Quelles avancées dans la recherche des vaccins et traitements ?
Quelles autres maladies découvertes depuis 2003 ?
Quels moyens ont été donnés aux chercheurs ?
La France et l’Europe sont elles prêtes à faire face à une épidémie ?
L’information des populations est elle adaptée aux risques ?
Ne doit on pas mieux informer pour ne pas paniquer la population ?
Les Intervenants
Des médecins et professeurs spécialisés ou ayant été confrontés à ces nouvelles
épizooties et pandémies (Professeur MOUTON de Tourcoing par exemple )
Des chercheurs de l’Institut Pasteur de LILLE
Programme d’information européen en santé environnementale
Pendant 3 ans (2004-2007), l’Institut de veille sanitaire (InVS) a contribué au projet européen ENHIS sur la construction d’un système d’information en santé environnementale. Ce projet a été coordonné par le centre européen en santé environnementale de l’Organisation mondiale de la santé .
A l’issue de la 4e conférence ministérielle pour l’Environnement et la Santé en2004, le système d’information en santé environnementale a été identifié comme « un élément essentiel destiné à soutenir l’élaboration des politiques publiques dans ce domaine, en permettant de fixer des priorités, en améliorant l’accès à l’information et en facilitant la communication avec le public, en facilitant les comparaisons entre pays et entre régions…».
L’InVS a coordonné le module sur la faisabilité de l’évaluation d’impact sanitaire pour différents facteurs environnementaux et a contribué à la construction d’indicateurs permettant de surveiller la santé environnementale dans les Etats Membres de l’Union européenne. Ce travail a été présenté par l’OMS à la conférence gouvernementale sur l’environnement et la santé à Vienne en 2007 afin d’évaluer les progrès depuis 2004. Ce projet a reçu le soutient des représentants de 52 pays européens de la région OMS-Europe et de diverses instances européennes.
Le projet ENHIS s’est terminé en octobre 2007.
Pour la suite, la Commission européenne soutiendra l’OMS uniquement pour actualiser les indicateurs définis et chaque Etat Membre devra se prononcer sur la nature de sa contribution, notamment sur :
– la remontée des données au niveau européen (OMS-Europe),
– la réponse aux demandes de l’OMS-Europe sur l’interprétation des indicateurs dans un contexte national et européen,
– les évolutions dans la sélection des indicateurs santé environnement.
Les implications pour la France méritent d’être discutées avec les partenaires impliqués à l’NVS et aux Ministères concernés. Il est proposé d’organiser en 2008 un atelier d’une journée pour analyser ces indicateurs et les suites de la contribution française.
Le programme EpiSouth
Réseau pour le contrôle des maladies transmissibles dans les pays d’Europe du Sud et du Bassin Méditerranéen
En 2005, « Année de la Méditerranée », la Commission européenne a encouragé certains Etats membres, dont la France, à élaborer un cadre de collaboration dans ledomaine de l’épidémiologie, visant à renforcer la surveillance des maladies transmissibles, la communication et la formation dans le bassin méditerranéen.
En effet, les pays du bassin méditerranéen partagent le même écosystème et la même histoire.
Au delà des divisions politiques, les populations ont toujours maintenu des échanges importants. Du point de vue épidémiologique, ces pays constituent un bloc homogène.
25 pays participent aujourd’hui à EpiSouth (Europe du sud, Balkans, Maghreb et Moyen-Orient). Le projet est composé de six programmes de travail coordonnés par des instituts de santé publique européens. La cohésion du projet est assurée par le partenaire principal (Italie) qui en développe le cadre opérationnel et assure la diffusion des informations épidémiologiques.
Trois programmes verticaux : «veille internationale et alertes transfrontalières» , «vaccination et populations migrantes» (Bulgarie) et « zoonoses émergentes transfrontalières » (Grèce), constituent la base technique.
Deux programmes horizontaux : réseau (Italie) et formation (Espagne) fournissent des outils nécessaires pour harmoniser ces programmes verticaux notamment en termes de renforcement des capacités et d’animation du réseau.
EpiSouth est un des rares projets de cette nature couvrant cette région. Il apporte les bénéfices suivants:
– collaboration étroite entre pays du bassin méditerranéen ;
– meilleure approche des contextes spécifiques à cette zone ;
– identification des lacunes éventuelles dans le domaine de la santé publique ;
– réaction rapide et efficace aux risques sanitaires ;
– renforcement global des capacités de détection et de réponse (aux maladies infectieuses) ;
– communication entre pays partenaires et diffusion de l’information entre institutions compétentes, réseau d’épidémiologistes.
EpiSouth, cofinancé par la Commission européenne, a officiellement débuté en décembre 2006. En mars 2007, pour la première fois, des représentants des 25 pays méditerranéens se sont réunis pour concevoir leur futur partenariat et ont confirmé leur volonté de collaborer activement à cet ambitieux projet.